Publicerad 2017-11-30, flyttad till transfusion.se 2020-05-13
Författare Jan Säfwenberg
Hemovigilans ska förbättra kvalitet och säkerhet inom transfusionsmedicinen nationellt. För att få hela den transfusionsmedicinska verksamheten kvalitetssäkrad, krävs ett brett blodövervakningssystem – hemovigilanssystem, omfattande hela kedjan ”från ven till ven” – som ska vara ett komplement till befintliga avvikelserapporteringssystem.
Ett blodövervakningssystem bör
Händelse i samband med insamling, kontroll, framställning, förvaring och distribution av blod och blodkomponenter eller användning på blodmottagare som kan leda till överföring av smitta eller sjukdom eller till döden, eller kan vara livshotande, invalidiserande eller medföra betydande funktionsnedsättning för blodmottagaren, eller kan leda till eller förlänga sjukdom eller behov av sjukhusvård. SOSFS 2009:28
Sådan icke avsedd reaktion hos blodgivare eller blodmottagare i samband med att blod och blodkomponenter tappas från blodgivaren eller används vid transfusion, som kan leda till döden, livshotande eller invalidiserande tillstånd eller som kan medföra betydande funktionsnedsättning, eller leda till eller förlänga sjukdom eller behov av sjukhusvård.
– det att identifiera och rapportera avvikelser, klarlägga och åtgärda orsakerna, dokumentera detta samt bedöma åtgärdernas effekt och sammanställa och återföra resultaten.Terminologifrämjandet, se fig. 1
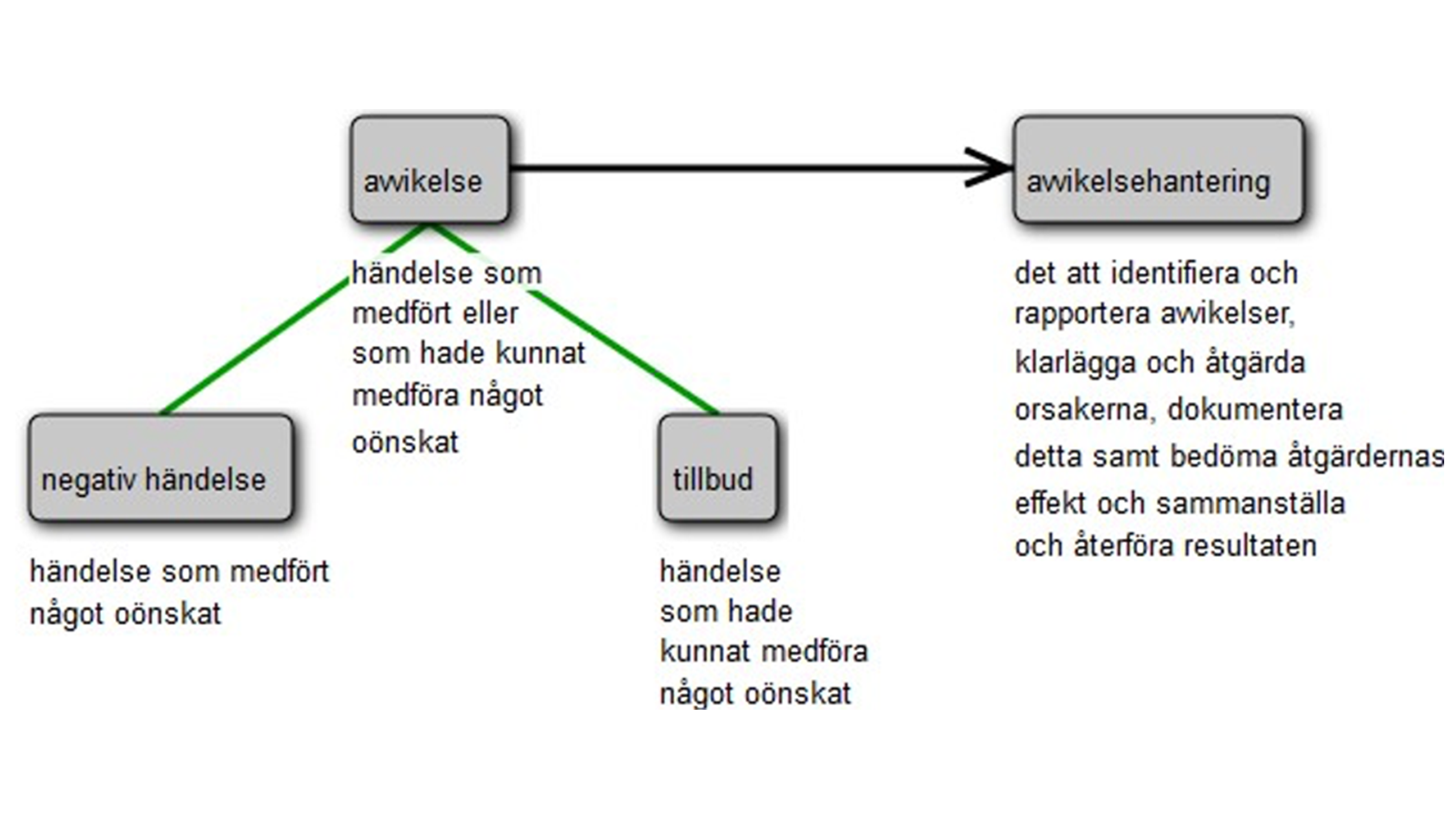
Hemovigilans (blodövervakning)
Standardiserad insamling och bedömning av information om avvikelser vid insamling, testning, framställning, lagring och distribution av blod och blodkomponenter samt ogynnsamma och oväntade effekter av utförd blodtransfusion. Enligt Definitioner och förkortningar.
Sannolikheten för att en biverkning hos en mottagare beror på blod eller blodkomponenter som har transfunderats, eller att en allvarlig avvikande händelse hos en givare beror på tappningsprocessen. Se bilaga 4.
Ordet vigilant kommer från latinets vigilare som betyder att vara vaksam.
Lidande, kroppslig eller psykisk skada eller sjukdom samt dödsfall som hade kunnat undvikas om adekvata åtgärder hade vidtagits vid patientens kontakt med hälso- och sjukvården. SOSFS 2011:9 .
Bloddirektiven riktar sig till regeringarna i medlemsländerna. Syftet är hög kvalitet och säkerhet på blodkomponenterna i medlemsstaterna. Härutöver vill man få rapport om allvarliga avvikande händelser, som påverkar kvaliteten och säkerheten på blodkomponenter, samt rapport om allvarliga biverkningar vid blodtransfusion, som kan hänföras till brister i kvalitet och säkerhet hos blodkomponenterna.
Observera att EU:s krav enbart omfattar de delar av hemovigilanskedjan som berör blodkomponenternas kvalitet och säkerhet.
Publicerat 2003-01-27. Av särskilt intresse för hemovigilans är bestämmelserna om:
Publicerat 2005-09-30. Mer detaljerade bestämmelser finns om:
Benämningar, definitioner och beskrivningar motsvarar dem i relevanta internationella sammanhang.
Inga kliniska symtom men fel blodenhet/fel patient transfunderad
Inga symtom efter transfusion, utan olika fel:
Hemolytiska transfusionsreaktioner
Hemolytisk transfusionsreaktion visar kliniska symtom och labresultat som tyder på förstöring av erytrocyter utlöst av transfusion.
Förkortning enl. ref. 1, ISBT: AHTR
Avsnitt i ref. 1: 2.1
En AHTR inträffar inom 24 tim efter transfusion.
Vanliga kliniska tecken på AHTR är:
Typiska labresultat:
Vid AHTR påvisas inte alla ovanstående kliniska och/eller laboratorietecken.
Blodgruppserologiska analyser visar vanligen avvikande resultat men frånvaro av serologiska fynd utesluter inte AHTR. Hemolys kan bero på icke-immunologiska faktorer, t.ex. medicinsk utrustning (pumpar, blodvärmare och cell-savers), läkemedel, hypotoniska lösningar, mm.
Förkortning enl. ref. 1, ISBT: DHTR
Avsnitt i ref. 1: 2.2
Inträffar vanligen 24 tim till 28 dagar efter transfusion. Ibland kan kliniska och lab-resultat likna AHTR men de är oftast mindre allvarliga. I visa fall är utebliven stegring av Hb efter transfusion enda tecknet på DHTR.
Icke hemolytiska transfusionsreaktioner
Förkortning enl. ref. 1, ISBT: FNHTR
Avsnitt i ref. 1: 3.1
Endast allvarliga febrila reaktioner som inträffar under eller inom 4 tim efter transfusion ska anmälas till BIS, som tillämpar de krav som satts för internationell jämförelse:
feber (≥39 °C) och förändring ≥2 °C jämfört med pretransfusion nivå,
frossa/skakningar
Endast allvarliga reaktioner ska anmälas till BIS.
Avsnitt: 3.2a
Börjar inom 1-45 min efter start av transfusion med respiratoriska symtom (larynxödem, heshet, dysfagi, stridor), lungsymtom (dyspné, hypoxemi, bronkospasm, hosta, cyanos), kardiovaskulära symtom (hypotension, chock, tachycardi, arrytmi, synkope), hudsymtom (urtikaria, utslag med klåda, rodnad, angioödem) och gatrointestinala symtom (illamående, kräkning, diarré, magkramp). Kräver vasopressorbehandling.
Diff. diagnos: vid akuta hemolytiska- och septiska reaktioner utvecklas snabbt feber och/eller frossa. Förekomst av mukokutana symtom och frånvaro av feber skiljer anafylaktiska reaktioner från akuta hemolytiska och septiska reaktioner
Avsnitt i ref. 1: 3.2
Är mindre fulminanta än anafylaktiska reaktioner, börjar inom 4 tim efter start av transfusion, med symtom som vid anafylaktiska reaktioner dock utan allvarligaste symtom som hypotension, chock, synkope. Behandlas endast med antihistaminer eller steroider.
Höga tryptas värden kan bekräfta diagnosen av allergisk reaktion.
Förkortning enl. ref. 1, ISBT: TRALI
Avsnitt i ref. 1: 3.3
Annan ref.: 2
Definition: Transfusionsreaktion som inträffar inom 6 tim efter avslutad transfusion: akut andnöd (PaO2/FiO2 ≤300 mmHg och/eller O2 saturation ≤90%), eventuell cyanos (blåmarmorerad hud) och rosafärgad skum som kommer ur luftvägarna eller endotracheal tub, bilaterala lunginfiltrat (s.k. vita lungor), hypoxemi och oftast svår hypotension (brukar vara svårbehandlad – utebliven effekt av inotropa mediciner och infusionsvätskor).
Hypertension och feber kan förekomma ibland. TRALI kan också vara associerad med en akut övergående (ca 16 tim) neutropeni och/eller leukopeni.
Diagnosen av TRALI bör vara en enkel klinisk diagnos, andra diagnoser ska uteslutas. Utredning av TRALI bör vara så detaljerad som möjligt (Lung-rtg, HLA-, granulocyt-, ev. monocytantikroppar, x-tester, mm). Förekomst av anti-HLA eller anti-HNA antikroppar hos blodgivare är inte nödvändig för TRALI diagnosen.
Andra diagnoser som ska uteslutas:
TRALI förekommer ofta om patienten redan före transfusion (two-hit hypotesen) har haft allvarlig försämrad lungfunktion och aktiverade granulocyter (t.ex. vid kardiopulmonell bypass, hematologisk malignitet, pneumoni, aspiration, sepsis, chock, multipel trauma, brännskador, akut pankreatit mm) och därför kallas ibland ALI p.g.a. tidigare lungskada.
”Riktig” TRALI (d.v.s. utan ALI före transfusion) förekommer mycket sällan.
Avsnitt: 3.3a
Annan ref.: 3
I visa fall, om granulocytaktivering är måttlig och patientens predisponerande sjukdom är lätt, kan transfusionsreaktion utebli eller resultera i en mild ”TRALI- reaktion” utan lungödem, men med symtom som t.ex. andnöd, med eller utan feber, BT-fall, BT-ökning, och där mekanisk/artificiell andningshjälp ej är nödvändig.
Förkortning enl. ref. 1, ISBT: TACO
Avsnitt i ref. 1: 3.4
TACO symtom: Dyspné, orthopné, cyanos, takykardi, hypertension, lungödem inom 6 tim efter avslutad transfusion. Dokumenterad positiv vätskebalans.
Ökning av BNP (brain natriuretisk polypeptid) kan förekomma vid TACO.
Detaljerade kriterier för TACO diagnosen är under revision (TACO definition revision group)
Förkortning enl. ref. 1, ISBT: TAD
Avsnitt i ref. 1: 3.6
Dyspné inom 24 tim efter transfusion som inte uppfyller kriterier för TRALI, TACO eller allergisk reaktion och som inte kan förklaras av patientens grundsjukdom.
Avsnitt i ref. 1: 3.5
Denna reaktion karakteriseras som fall i systoliskt blodtryck ≥30 mm Hg under eller inom 1 tim efter avslutad transfusion och systoliskt blodtryck ≤80 mm Hg. De flesta reaktioner inträffar mycket snabbt efter transfusionsstart (inom några minuter). Avbruten transfusion
och supportiv behandling ger snabb återhämtning. Denna typ av reaktion inträffar oftare hos patienter som behandlas med ACE-hämmare. Andra orsaker, t.ex. allergisk reaktion, som ofta ger blodtrycksfall ska uteslutas.
Andra symtom som ansiktsrodnad, dyspné eller magkramp kan också förekomma men hypotension är ofta enda manifestationen.
Förkortning enl. ref. 1, ISBT: PTP
Avsnitt i ref. 1: 3.7
Trombocytopeni 5-12 dagar efter transfusion av cellulära blodkomponenter och förekomst av anti-HPA antikroppar i patientprov.
Förkortning enl. ref. 1, ISBT: TA-GVHD
Avsnitt i ref. 1: 3.8
TA-GVHD symtom inkluderar feber, hudutslag, diarré, leversvikt, diarré, pancytopeni och karakteristiska histologiska biopsifynd 1-6 veckor efter transfusion utan någon annan orsak.
Förekomst av chimerism stödjer TA-GVHD.
Andra transfusionsreaktioner
Avsnitt i ref. 1: 3.9a
Annan ref.: 2
Ferritin >1000 mikrogram/l, med eller utan organdysfunktioner efter upprepade erytrocyttransfusioner.
Avsnitt i ref. 1: 3.9b
Extremt högt kaliumvärde (>5 mmol/L) eller ökning (>1,5 mmol/L) inom 1tim efter transfusion.
Förkortning enl. ref. 2: APTR
Avsnitt: 3.9d
Annan ref.: 2
Oftast inom 30 min efter transfusionsstart. Intensiv smärta kan vara lokaliserad lumbalt, i ben/armar, bröst, rygg/flank och magen. Andra symtom kan också vara: dyspné, tachypné, hypertension, frossa, huvudvärk, mm. Smärtan avtar ca 30 min efter avslutad transfusion. Alla blodkomponenter kan vara associerade, fr.a. trombocytkoncentrat.
Förkortning: TTI
Avsnitt: 4.7
Transfusionsöverförd bakterie-, virus- eller parasitinfektion.
Förkortning enl. ref. 1, ISBT: UCT
Avsnitt i ref. 1: 3.9c
Blodsäkerhetslagen, utfärdad den 1 juni 2006, innehåller bestämmelser som syftar till att skydda människors hälsa när blod och blodkomponenter från människor hanteras för att användas vid transfusion eller läkemedelstillverkning. Blodsäkerhetslagen är utformad som en s.k. ramlag och redovisar de krav som ska vara uppfyllda för att en inrättning ska tillåtas bedriva blodverksamhet enligt EU:s krav.
Inspektionen för vård och omsorg (IVO) och Läkemedelsverket är tillsynsmyndigheter som kan utfärda tillstånd att bedriva blodverksamhet. Blodcentralerna ska rapportera misstänkta eller konstaterade allvarliga avvikande händelser till tillsynsmyndigheterna. Förordningen om blodsäkerhet (2006:497).
Lagen är tillämplig på blodverksamhet som bedrivs vid blodcentraler och verksamhet vid sjukhusblodbanker.
Lagen ska inte vara tillämplig vid hantering av enbart blodstamceller efter att dessa har utvunnits ur blodet.
| Grad av orsakssamband | Förklaring | |
| NA | Kan inte fastställas | Det finns inte tillräckliga uppgifter för att fastställa ett orsakssamband |
| 0 | Uteslutet | Det finns avgörande bevis utom allt rimligt tvivel för att biverkningen beror på andra orsaker |
| 0 | Inte troligt | Det finns klara bevis för att biverkningen beror på andra orsaker än blodet eller blodkomponenterna |
| 1 | Möjligt | Det går inte med bestämdhet att säga om biverkningen beror på blodet eller blodkomponenterna eller på andra orsaker |
| 2 | Troligt, sannolikt | Det finns klara bevis för att biverkningen beror på blodet eller blodkomponenterna |
| 3 | Säkert | Det finns avgörande bevis utom allt rimligt tvivel för att biverkningen beror på blodet eller blodkomponenterna |
Svensk Förening för Klinisk Immunologi och Transfusionsmedicin | Sektion inom Svenska Läkaresällskapet | Specialitetsförening inom Sveriges läkarförbund
Krav på avvikelsehantering och rapportering finns i de föreskrifter som Socialstyrelsen och Läkemedelsverket har utfärdat om blodverksamhet och om medicintekniska produkter.
Krav på avvikelsehantering och rapportering finns också i föreskrifter om ledningssystem och om anmälningsskyldighet enligt Lex Maria, se SOSFS 2011:9, HSLF-FS 2017:40 och HSLF-FS 2017:41
Verksamhetschefen för en blodcentral ska se till att allvarliga avvikande händelser, som kan påverka blodets och blodkomponenternas kvalitet eller säkerhet, dokumenteras, utreds och anmäls till IVO och till Läkemedelsverket (länkar). SOSFS 2009:28, LVFS 2006:16k och HSLF- FS 2017:41.
IVO:s blankett ”Anmälan av allvarlig avvikande händelse vid blodverksamhet” används, dels för en Preliminär anmälan av den inträffade allvarliga avvikande händelsen, dels, efter avslutad utredning, för Slutlig anmälan med orsaksanalys och vidtagna korrigerande åtgärder.
Allvarliga avvikande händelser som har observerats under insamling och kontroll, ska rapporteras till båda myndigheterna.
Allvarliga avvikande händelser som har observerats under framställning, förvaring och distribution av blod och blodkomponenter, eller som har orsakats av materialfel, ska rapporteras till IVO om det avser blodkomponenter för transfusion och till Läkemedelsverket om det avser blodkomponenter för läkemedelstillverkning.
Avvikande allvarliga avvikande händelser under året sammanfattas på blanketten ”Årlig rapport om allvarliga avvikande händelser vid blodverksamhet”.
Verksamhetschefen för en blodcentral ska se till att allvarliga biverkningar, som har observerats hos blodmottagare under eller efter transfusion och som kan hänföras till blodets och blodkomponenternas kvalitet eller säkerhet, dokumenteras, utreds och anmäls till IVO.
Blanketten ”Anmälan av allvarlig biverkning vid blodverksamhet” används, dels för en Preliminär anmälan av den inträffade allvarliga biverkningen, dels, efter avslutad utredning, en Slutlig anmälan med bedömning av orsakssamband och vidtagna korrigerande åtgärder.
Rapporterade allvarliga biverkningar ska bedömas enligt de grader av orsakssamband som anges, se bilaga 4. Observera att enligt Artikel 5 i direktiv 2005/61/EG ska endast allvarliga biverkningar som har bedömts vara av orsakssamband grad 2 eller 3 rapporteras.
“Kliniskt utfall” bör inte redovisas i denna blankett.
Allvarliga biverkningar under året sammanfattas på blanketten ”Årlig rapport om allvarliga biverkningar vid blodverksamhet” som ska lämnas till IVO.
Socialstyrelsen har utfärdat föreskrifter om anmälningsskyldighet enligt Lex Maria. HSLF- FS 2017:40 .
Om en blodgivare eller en blodmottagare drabbats av eller riskerat att drabbas av vårdskada vid blodgivningen eller vid blodtransfusionen, ska en anmälan göras enligt Lex Maria, se HSLF-FS 2017:41.
Anmälningar enligt Lex Maria går via chefläkaren och handläggs av IVO.
Tillverkare ska anmäla allvarliga olyckor och tillbud med CE-märkta medicintekniska produkter till Läkemedelsverket. Det är också tillverkaren, eventuellt genom leverantören, som ska informera användarna om t.ex. återkallande, åtgärder som ska vidtas eller risker som har samband med en medicinteknisk
Vårdgivaren ska säkerställa att rutiner finns för bl.a. utredning, bedömning och rapportering av negativa händelser och tillbud med medicinska produkter. En av verksamhetschefen utsedd anmälningsansvarig person ska svara för anmälan till tillverkaren, Läkemedelsverket och information till IVO. För egentillverkade medicintekniska produkter ska anmälan göras till IVO. En blankett som tagits fram av Socialstyrelsen och Läkemedelsverket ska användas. 6 i SOSFS 2008:1 .
I Socialstyrelsens föreskrifter om ledningssystem finns krav på riskanalys, avvikelsehantering, egenkontroll, uppföljning och erfarenhetsåterföring samt dokumentation. SOSFS 2011:9.
Detaljerade krav för blodverksamhet finns i Socialstyrelsens och Läkemedelsverkets föreskrifter om blodverksamhet. SOSFS 2009:28 och LVFS 2006:16 .
Indragning och återkallelser av bristfälligt material, reagens, utrustning, blodenheter m.m. kan beordras av Läkemedelsverket eller IVO.
Föreskrifter om åtgärder när aktuell blodgivare visar sig smittad finns i Socialstyrelsens och Läkemedelsverkets föreskrifter om blodverksamhet. SOSFS 2009:28 och LVFS 2006:16 .
Svensk förening för klinisk immunologi och transfusionsmedicin samlar in, sammanställer och publicerar årligen uppgifter om antal blodgivare, blodtappningar, sållningstester, producerade blodenheter, utförda transfusioner, m.m. Uppgifterna publiceras i Blodverksamheten i Sverige: omfattning, kvalitet och säkerhet.
Varje blodcentralsorganisation bör utse en namngiven uppgiftslämnare som rapporterar till föreningens arbetsgrupp för Blodverksamheten i Sverige: omfattning, kvalitet och säkerhet.
Statistiska uppgifter om blodverksamhet ska av verksamhetschefen årligen rapporteras till IVO. SOSFS 2009:28
Folkhälsomyndigheten ansvarar för regelbunden insamling, sammanställning och publicering av epidemiologiska
I samarbete med Svensk förening för klinisk immunologi och transfusionsmedicin insamlar och sammanställer Folkhälsomyndigheten uppgifter om utfall vid blodsållning av blodgivare och nyanmälningar. Utfallet redovisas i Blodverksamheten i Sverige: omfattning, kvalitet och säkerhet.
Varje blodcentralsorganisation bör utse en namngiven uppgiftslämnare till Folkhälsomyndigheten. Blankett för uppgiftslämning, två gånger per år, finns här.
Europarådets Ministerkommitté har i “On the hospital’s and clinician’s role in the optimal use of blood and blood products” rekommenderat former för nationella och lokala transfusionskommittéer.
Transfusionskommittéer bör etableras länsvis. I gruppen bör ingå specialistläkare i klinisk immunologi och transfusionsmedicin och intresserade representanter (läkare, sjuksköterskor) från de mest transfunderande klinikerna. Det är viktigt att representant för sjukhusledningen, t.ex. chefläkare, ingår.
Exempel på uppgifter för transfusionskommittén: